Codes EMDN : Structure et Applications
En vertu des règlements de l'Union Européenne relatifs aux dispositifs médicaux, MDR (EU 2017/745) et IVDR (EU 2017/746), tous les dispositifs doivent désormais être inclus dans un système de classification commun. Ce système classification, appelé Nomenclature Européenne des Dispositifs Médicaux (EMDN pour European Medical Device Nomenclature), joue un rôle essentiel dans la mise sur le marché des dispositifs, leur traçabilité et le contenu des documentations techniques.
Qu'est-ce que l'EMDN ?
EMDN (European Medical Device Nomenclature) est un système de classification des dispositifs médicaux gratuit et en accès libre, développé par la Commission Européenne et utilisé dans la base de données EUDAMED.
Il est dérivé du système italien CND (Classificazione Nazionale Dispositivi medici). Il a été lancé le 4 mai 2021 et mis à jour en 2025. Son accès gratuit et libre, accessible à tous les fabricants de l'UE, est l'une de ses principales caractéristiques.
Pour tous les produits couverts par le MDR et l'IVDR, l'EMDN intervient dans :
- Les enregistrements EUDAMED
- Le mapping UDI-DI
- La description technique du produit
- La documentation à fournir aux organismes notifiés (NBs).
Structure de l'EMDN
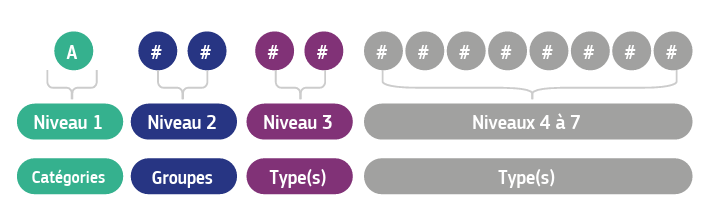
L'EMDN utilise une structure à sept niveaux similaire au système italien CND (Classificazione Nazionale Dispositivi medici). Les niveaux sont structurés comme décrit ci-dessous :
- Catégorie (Lettre) – Catégorie du dispositif (par exemple, A = dispositifs actifs)
- Groupe (deux chiffres) – Classification plus précise au sein de la catégorie
- Type (deux chiffres) – Type plus spécifique
- Unité (deux chiffres) – Regroupement spécifique de produits
- Niveau 5 – Regroupement descriptif
- Niveau 6 – Fonction détaillée
- Niveau 7 – Identifiants spécifiques au dispositif ou uniques (facultatif/à venir)
Exemple:
- Code : P090909
- Interprétation:
- P : Dispositifs implantables de prothèse et d'ostéosynthèse
- 09 : Prothèses orthopédiques, dispositifs d'ostéosynthèse, dispositifs pour la synthèse des tendons et des ligaments
- 09 : Prothèses du genou
- 09 : Prothèses bicompartimentales du genou de première intention
Cette structure permet une classification plus fine, essentielle pour la précision réglementaire.
Application des codes EMDN
- Enregistrement EUDAMED
Tous les fabricants doivent attribuer le code EMDN approprié à chacun de leurs dispositifs médicaux lors de leur enregistrement dans la base de données EUDAMED. Cela garantit une identification uniforme dans toute l'UE. - UDI et traçabilité
Les codes EMDN soutiennent le système d'identification unique des dispositifs (UDI) en associant la nomenclature EMDN aux enregistrements UDI à des fins de traçabilité et de surveillance post-commercialisation. - Évaluation par les organismes notifiés
Les organismes notifiés utilisent les codes EMDN pour définir leurs domaines de compétences. La mise en correspondance des dispositifs avec les organismes notifiés devient plus transparente. - Achats et remboursements
Certains états membres utilisent l'EMDN pour les évaluations des technologies de santé, les appels d'offres publics et les systèmes de remboursement.
Comparaison avec d'autres systèmes (par exemple, GMDN)
Bien que le GMDN (Global Medical Device Nomenclature) soit largement utilisé, l'EMDN est librement accessible et officiellement adopté par l'UE. En voici les principales différences :
|
Caractéristique |
EMDN |
GMDN |
|
Propriété |
Commission Européenne |
Agence GMDN (Royaume-Uni) |
|
Accès |
Gratuit |
Sur abonnement |
|
Alignement réglementaire |
Règlement européen sur les dispositifs médicaux (MDR) |
Mondial (non spécifique au MDR) |
|
Langue |
Multilingue |
Anglais uniquement |
Défis et perspectives d'avenir
- La cartographie à partir des systèmes existants tels que le GMDN vers l'EMDN nécessite des efforts et une expertise.
- La mise à jour et la maintenance de la nomenclature dépendent des progrès technologiques et des exigences réglementaires.
- L'intelligence artificielle et les outils d'automatisation pourraient jouer un rôle dans l'attribution future des codes EMDN.
Quelles sources doivent être prises en compte pour déterminer l'EMDN ?
- MDCG 2021-12 Rev.1 : FAQ concernant l'EMDN
- MDCG 2024-2 Rev.1 : Procédures de mise à jour
- Guide EMDN de MedTech Europe (2025)
- Navigateur EMDN